На протяжении всей своей 100-летней истории нейронаука придерживалась догмы: мозг взрослого человека не подвержен изменениям. Считалось, что человек может терять нервные клетки, но не обретать новые. Действительно, если бы мозг был способен к структурным изменениям, как бы сохранялась память?
Кожа, печень, сердце, почки, легкие и кровь могут образовывать новые клетки для замены поврежденных. Вплоть до недавнего времени специалисты считали, что такая способность к регенерации не распространяется на центральную нервную систему, состоящую из головного и спинного мозга.
Однако за последние пять лет нейробиологи открыли, что мозг все же меняется в течение жизни: происходит образование новых клеток, позволяющих справиться с возникающими трудностями. Такая пластичность помогает мозгу восстанавливаться после травмы или заболевания, увеличивая свои потенциальные возможности.
Нейробиологи на протяжении десятков лет ищут способы улучшить состояние мозга. Стратегия лечения основывалась на восполнении недостатка нейромедиаторов — химических веществ, передающих сообщения нервным клеткам (нейронам). При болезни Паркинсона, например, мозг больного теряет способность вырабатывать нейромедиатор дофамин, поскольку производящие его клетки гибнут. Химический «родственник» дофамина, L-Допа, может временно облегчить состояние больного, но не излечить его. Для замены нейронов, погибающих при таких неврологических заболеваниях, как болезни Гентингтона и Паркинсона, и при травмах спинного мозга, нейробиологи пытаются имплантировать стволовые клетки, полученные из эмбрионов. В последнее время исследователи заинтересовались нейронами, полученными из эмбриональных стволовых клеток человека, которые при определенных условиях можно заставить образовывать в чашках Петри любые типы клеток человеческого организма.
Несмотря на то что у стволовых клеток много преимуществ, очевидно, следует развивать способности взрослой нервной системы к самовосстановлению. Для этого необходимо ввести вещества, стимулирующие мозг к образованию собственных клеток и восстановлению поврежденных нервных цепей.
Новорожденные нервные клетки
В 1960 — 70-х гг. исследователи пришли к выводу, что центральная нервная система млекопитающих способна к регенерации. Первые эксперименты показали, что основные ветви нейронов взрослого головного и спинного мозга — аксоны могут восстанавливаться после повреждения. Вскоре было обнаружено рождение новых нейронов в мозге взрослых птиц, обезьян и людей, т.е. нейрогенез.
Возникает вопрос: если центральная нервная система может образовывать новые нейроны, способна ли она восстанавливаться в случае болезни или травмы? Для того чтобы ответить на него, необходимо понять, как происходит нейрогенез во взрослом мозге и каким образом можно его стимулировать.
Рождение новых клеток происходит постепенно. Так называемые мультипотентные стволовые клетки в мозге периодически начинают делиться, давая начало другим стволовым клеткам, которые могут вырасти в нейроны или опорные клетки, называемые глией. Но для созревания новорожденные клетки должны избегать влияния мультипотентных стволовых клеток, что удается лишь половине из них — остальные гибнут. Такое расточительство напоминает процесс, происходящий в организме до рождения и в раннем детстве, когда возникает больше нервных клеток, чем необходимо для образования мозга. Выживают только те из них, которые формируют действующие связи с другими.
Станет ли уцелевшая молодая клетка нейроном или глиальной клеткой, зависит от того, в каком участке мозга она окажется и какие процессы будут происходить в этот период. Новому нейрону требуется более месяца, чтобы начать полноценно функционировать. посылать и принимать информацию. Таким образом. нейрогенез представляет собой не одномоментное событие. а процесс. который регулируется веществами. называемыми факторами роста. Например, фактор, названный «звуковой еж» (sonic hedgehog), обнаруженный впервые у насекомых, регулирует способность незрелых нейронов к пролиферации. Фактор notch и класс молекул. названных морфогенетическими протеинами кости, видимо, определяют, станет ли новая клетка глиальной или нервной. Как только это произойдет. другие факторы роста. такие как мозговой нейротрофический фактор (BDNF). нейротрофины и инсулинподобный фактор роста (IGF), начинают поддерживать жизнедеятельность клетки, стимулируя ее созревание.
Место действия
Новые нейроны возникают во взрослом мозге млекопитающих не случайно и. по всей видимости. образуются только в заполненных жидкостью пустотах в переднем мозге — в желудочках, а также в гиппокампе — структуре, спрятанной глубоко в мозге. имеющей форму морского конька. Нейробиологи доказали, что клетки, которым суждено стать нейронами. перемещаются из желудочков в обонятельные луковицы. которые получают информацию от клеток, расположенных в слизистой носа и чувствительных к запаху. Никто точно не знает, почему обонятельной луковице требуется столько новых нейронов. Легче предположить, зачем они нужны гиппокампу: поскольку эта структура важна для запоминания новой информации, дополнительные нейроны, вероятно. способствуют упрочению связей между нервными клетками, повышая способность мозга обрабатывать и хранить сведения.
Процессы нейрогенеза также обнаружены за пределами гиппокампа и обонятельной луковицы, например, в префронтальной коре — обители интеллекта и логики. а также в других областях взрослого головного и спинного мозга. Последнее время появляются все новые подробности о молекулярных механизмах, управляющих нейрогенезом, и о химических стимулах, регулирующих его. и мы вправе надеяться. что со временем можно будет искусственно стимулировать нейрогенез в любой части мозга. Зная, как факторы роста и локальное микроокружение управляют нейрогенезом, исследователи рассчитывают создать методы лечения, позволяющие восстановить больной или поврежденный мозг.
С помощью стимулирования нейрогенеза можно улучшить состояние пациента при некоторых неврологических заболеваниях. Например. причина инсульта — закупорка сосудов головного мозга, в результате чего из-за недостатка кислорода гибнут нейроны. После инсульта в гиппокампе начинает развиваться нейрогенез, стремящийся «вылечить» поврежденную ткань мозга с помощью новых нейронов. Большинство новорожденных клеток гибнет, однако некоторые успешно мигрируют к поврежденному участку и превращаются в полноценные нейроны. Несмотря на то что для компенсации повреждений при тяжелом инсульте этого недостаточно. нейрогенез может помочь мозгу после микроинсультов,которые часто проходят незамеченными. Сейчас нейробиологи пытаются применять васкуло-эпидермальный фактор роста (VEGF) и фактор роста фибробластов (FGF) для усиления естественного восстановления.
Оба вещества представляют собой крупные молекулы, которые с трудом преодолевают гематоэнцефалический барьер, т.е. сеть тесно переплетенных клеток, выстилающих кровеносные сосуды мозга. В 1999 г. биотехнологическая компания Wyeth-Ayerst Laboratories and Scios из Калифорнии приостановила клинические испытания FGF применяемого для лечения инсульта. поскольку его молекулы не попадали в мозг. Некоторые исследователи пытались решить эту задачу, соединяя молекулу FGF с другой, которая вводила клетку в заблуждение и заставляла ее захватывать весь комплекс молекул и переносить его в ткань мозга. Другие ученые методами генной инженерии создавали клетки, вырабатывающие FGF. и трансплантировали их в мозг. Пока подобные эксперименты проводились лишь на животных.
Стимулирование нейрогенеза может оказаться действенным при лечении депрессии. главной причиной которой (помимо генетической предрасположенности) считается хронический стресс. ограничивающий, как известно. количество нейронов в гиппокампе. Многие из выпускаемых лекарственных средств. показанных при депрессии. в том числе прозак. усиливают нейрогенез у животных. Интересно, что для снятия депрессивного синдрома с помощью этого препарата требуется один месяц — столько же. сколько и для осуществления нейрогенеза. Возможно. депрессия отчасти вызвана замедлением данного процесса в гиппокампе. Последние клинические исследования с применением методов визуализации нервной системы подтвердили. что у пациентов с хронической депрессией гиппокамп меньше, чем у здоровых людей. Длительное применение антидепрессантов. похоже. подстегивает нейрогенез: у грызунов. которым давали эти препараты на протяжении нескольких месяцев. в гиппокампе возникали новые нейроны.
Как мозг создает новые нейроны
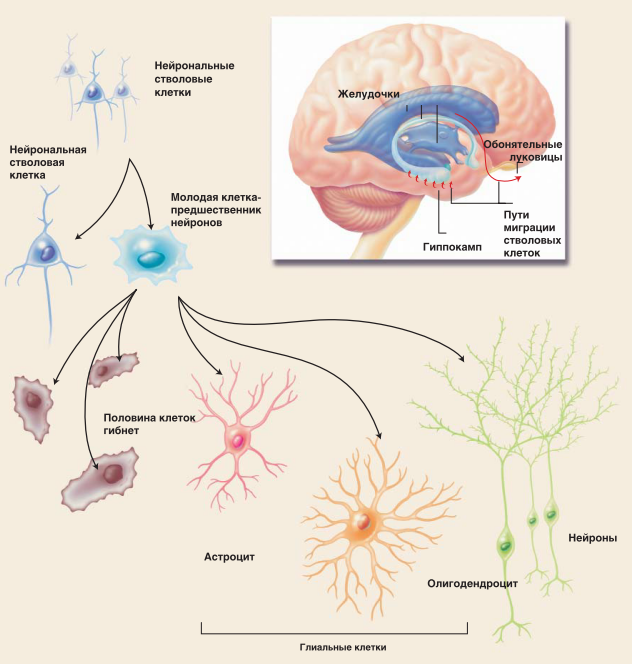
Нейрональные стволовые клетки дают начало новым клеткам мозга. Они периодически делятся в двух основных областях: в желудочках (фиолетовый цвет), которые заполнены спинномозговой жидкостью, питающей центральную нервную систему, и в гиппокампе (голубой цвет) — структуре, необходимой для обучения и памяти. При пролиферации стволовых клеток (внизу) образуются новые ствоповые клетки и клетки-предшественники, которые могут превратиться либо в нейроны, либо в поддерживающие клетки, называемые глиальными (астроциты и дендроциты). Однако дифференцировка новорожденных нервных клеток может произойти только после того, как они уйдут прочь от своих предков (красные стрелки), что удается в среднем лишь половине из них, а остальные гибнут. Во взрослом мозге новые нейроны были обнаружены в гиппокампе и обонятельных луковицах, необходимых для восприятия запахов. Ученые надеются заставить взрослый мозг восстанавливаться, вызывая деление и развитие нейрональных стволовых клеток или клеток-предшественников там и тогда, где и когда это необходимо.
Стволовые клетки как метод лечения
Потенциальным средством для восстановления поврежденного мозга исследователи считают два типа стволовых клеток. Во-первых, нейрональные стволовые клетки взрослого мозга: редкие первичные клетки, сохранившиеся от ранних стадий эмбрионального развития, обнаруженные как минимум в двух областях мозга. Они могут делиться на протяжении всей жизни, давая начало новым нейронам и поддерживающим клеткам, называемым глией. Ко второму типу относятся человеческие эмбриональные стволовые клетки, выделенные из зародышей на очень ранней стадии развития, когда весь эмбрион состоит примерно из ста клеток. Такие эмбриональные стволовые клетки могут давать начало любым клеткам организма.
В большинстве исследований производится наблюдение за ростом нейрональных стволовых клеток в культуральных чашках. Они могут там делиться, их можно генетически пометить и затем трансплантировать назад в нервную систему взрослого индивидуума. В экспериментах, которые пока проводились только на животных, клетки хорошо приживаются и могут дифференцироваться в зрелые нейроны в двух областях мозга, где образование новых нейронов происходит и в норме, — в гиппокампе и в обонятельных луковицах. Однако в других областях нейрональные стволовые клетки, взятые из взрослого мозга, не торопятся становиться нейронами, хотя могут стать глией.
Проблема со взрослыми нейрональными стволовыми клетками состоит в том, что они пока еще незрелые. Если взрослый мозг, в который их пересадили, не будет вырабатывать сигналы, необходимые для стимуляции их развития в определенный тип нейронов — например в гиппокампальный нейрон, — они либо погибнут, либо станут глиальной клеткой, либо так и останутся недифференцированной стволовой клеткой. Для решения этого вопроса необходимо определить, какие биохимические сигналы заставляют нейрональную стволовую клетку стать нейроном данного типа, и затем направить развитие клетки по такому пути прямо в культуральной чашке. Ожидается, что после трансплантации в заданный участок мозга эти клетки останутся нейронами того же типа, сформируют связи и начнут функционировать.
Устанавливая важные связи
Поскольку проходит около месяца с момента деления нейрональной стволовой клетки до тех пор, пока ее потомок не включится в функциональные цепи мозга, роль этих новых нейронов в поведении, вероятно, определяется не столько родословной клетки, сколько тем, как новые и уже существующие клетки соединяются друг с другом (образуя синапсы) и с существующими нейронами, формируя нервные цепи. В процессе синаптогенеза так называемые шипики на боковых отростках, или дендритах, одного нейрона соединяются с основной ветвью, или аксоном, другого нейрона.
Как показывают недавние исследования, дендритные шипики (внизу) могут менять свою форму в течение нескольких минут. Это свидетельствует о том, что синаптогенез может лежать в основе обучения и памяти. Одноцветные микро-фотографии мозга живой мыши (красная, желтая, зеленая и голубая) были сделаны с интервалом в одни сутки. Многоцветное изображение (крайнее справа) представляет собой те же фотографии, наложенные друг на друга. Участки, не претерпевшие изменений, выглядят практически белыми.
http://www.braintools.ru/article/8843

Помоги мозгу
Еще одно заболевание, провоцирующее нейрогенез, — болезнь Альцгеймера. Как показали недавние исследования, в органах мыши. которой были введены гены человека, пораженные болезнью Альцгеймера. обнаружены различные отклонения нейрогенеза от нормы. В результате такого вмешательства у животного в избытке вырабатывается мутантная форма предшественника человеческого амилоидного пептида, и уровень нейронов в гиппокампе падает. А гиппокамп мышей с мутантным геном человека. кодирующим белок пресенилин. обладал малым количеством делящихся клеток и. соответственно. меньшим числом выживших нейронов. Введение FGF непосредственно в мозг животных ослабляло тенденцию; следовательно. факторы роста могут стать хорошим средством лечения этого разрушительного заболевания.
Следующий этап исследований — факторы роста, управляющие различными стадиями нейрогенеза (т.е. рождением новых клеток, миграцией и созреванием молодых клеток), а также факторы, тормозящие каждый этап. Для лечения таких заболеваний, как депрессия, при которой снижается количество делящихся клеток, необходимо найти фармакологические вещества или другие методы воздействия. усиливающие пролиферацию клеток. При эпилепсии, видимо. новые клетки рождаются. но затем мигрируют в ложном направлении, и нужно понять. как направить «заблудшие» нейроны по правильному пути. При злокачественной глиоме мозга глиальные клетки пролиферируют и образуют смертельно опасные разрастающиеся опухоли. Хотя причины возникновения глиомы еще не ясны. некоторые полагают. что она возникает в результате неконтролируемого разрастания стволовых клеток мозга. Лечить глиому можно с помощью природных соединений. регулирующих деление таких стволовых клеток.
Для лечения инсульта важно выяснить. какие факторы роста обеспечивают выживание нейронов и стимулируют превращение незрелых клеток в здоровые нейроны. При таких заболеваниях. как болезнь Гентингтона. амиотрофический боковой склероз (АЛС) и болезнь Паркинсона (когда гибнут совершенно конкретные типы клеток, что ведет к развитию специфических когнитивных или моторных симптомов). данный процесс происходит наиболее часто, поскольку клетки. с которыми связаны эти болезни, располагаются в ограниченных областях.
Возникает вопрос: как управлять процессом нейрогенеза при том или ином типе воздействия, чтобы контролировать количество нейронов, поскольку их избыток также представляет опасность? Например, при некоторых формах эпилепсии нейрональные стволовые клетки продолжают делиться даже после того, как новые нейроны уже утрачивают способность устанавливать полезные связи. Нейробиологи предполагают, что «неправильные» клетки остаются недозрелыми и оказываются в ненужном месте. формируя т.н. фикальные корковые дисплазии (ФКД), генерирующие эпилептиформные разряды и вызывая эпилептические припадки. Не исключено, что введение факторов роста при инсульте. болезни Паркинсона и других заболеваниях может заставить нейрональные стволовые клетки делиться чересчур быстро и привести к сходным симптомам. Поэтому исследователи должны сначала изучить применение факторов роста для индукции рождения, миграции и созревания нейронов.
При лечении травм спинного мозга, АЛС или рассеянного склероза необходимо заставить стволовые клетки производить олигодендроциты, одну из разновидностей глиальных клеток. Они необходимы для коммуникации нейронов друг с другом. поскольку изолируют длинные аксоны, проходящие от одного нейрона к другому. предотвращая рассеяние проходящего по аксону электрического сигнала. Известно, что стволовые клетки в спинном мозге обладают способностью время от времени производить олигодендроциты. Исследователи применили факторы роста для стимулирования данного процесса у животных с травмой спинного мозга и получили положительные результаты.
Зарядка для мозга
Одна из важных особенностей нейрогенеза в гиппокампе состоит в том, что персональный опыт индивидуума может влиять на скорость деления клеток, количество выживших молодых нейронов и их способность встраиваться в нервную сеть. Например. когда взрослых мышей переселяют из обычных и тесных клеток в более удобные и просторные. у них происходит значительное усиление нейрогенеза. Исследователи обнаружили, что тренировки мышей в колесе для бега достаточно для того, чтобы удвоить количество делящихся клеток в гиппокампе, что ведет к резкому увеличению числа новых нейронов. Интересно, что регулярная физическая нагрузка может снять депрессию у людей. Возможно. это происходит благодаря активации нейрогенеза.
Если ученые научатся управлять нейрогенезом, то наши представления о заболеваниях и травмах мозга кардинально изменятся. Для лечения можно будет использовать вещества, избирательно стимулирующие определенные этапы нейрогенеза. Фармакологическое воздействие будет сочетаться с физиотерапией, усиливающей нейрогенез и стимулирующей определенные области мозга к встраиванию в них новых клеток. Учет взаимосвязей между нейрогенезом и умственной и физической нагрузками позволит снизить риск возникновения неврологических заболеваний и усилить природные репаративные процессы в мозге.
Путем стимуляции роста нейронов в мозге здоровые люди получат возможность улучшить состояние своего организма. Однако вряд ли им понравятся инъекции факторов роста, с трудом проникающих сквозь гематоэнцефалический барьер после введения в кровоток. Поэтому специалисты ищут препараты. которые можно было бы выпускать в виде таблеток. Подобное лекарство позволит стимулировать работу генов, кодирующих факторы роста, непосредственно в мозге человека.
Улучшить деятельность мозга возможно также путем генной терапии и трансплантации клеток: искусственно выращенные клетки, производящие конкретные факторы роста. можно имплантировать в определенные области мозга человека. Также предлагается вводить в организм человека гены, кодирующие производство различных факторов роста, и вирусы. способные доставить эти гены до нужных клеток мозга.
Пока не ясно. какой из методов окажется наиболее перспективным. Исследования, проведенные на животных, показывают. что применение факторов роста может нарушить нормальное функционирование мозга. Процессы роста могут вызвать образование опухолей, а трансплантированные клетки — выйти из под контроля и спровоцировать развитие рака. Такой риск может быть оправдан только при тяжелых формах болезни Гентингтона. Альцгеймера или Паркинсона.
Оптимальный способ стимулирования деятельности мозга — интенсивная интеллектуальная деятельность в сочетании со здоровым образом жизни: физическая нагрузка. хорошее питание и полноценный отдых. Экспериментально подтверждается и то. что на связи в мозге влияет окружающая среда. Возможно. когда-нибудь в жилых домах и офисах люди будут создавать и поддерживать специально обогащенную среду для улучшения функционирования мозга.
Если науке удастся понять механизмы самовосстановления нервной системы, то в скором будущем исследователи овладеют методами. позволяющими использовать собственные ресурсы мозга для его восстановления и совершенствования.
Источник: http://www.braintools.ru/article/8843 |
 Главная
Главная  Каталог статей
Каталог статей Регистрация
Регистрация Вход
Вход
